1. 화학 결합과 화학 반응
화학 결합(chemical bond)은 자석 사이의 상호작용에 비유할 수 있다. 서로 반대인 두 자극이 가까이 있으면 인력이 작용하여 자기적 결합이 형성된다. 반대로, 서로 같은 두 자극이 가까이 있으면 반발력도 생긴다. 음전하를 띤 전자구름은 서로를 밀어내고, 양전하를 띤 핵도 가까이 있으면 반발력이 생긴다. 이러한 힘들이 균형을 이루도록 원자들이 배열되면 화학 결합이 형성되는 것이다. 하지만 자석과는 달리, 핵끼리 글자 그대로 붙는 것이 아니라, 가장 안정한 핵간 거리를 결정하는 복잡한 힘의 균형에 의해 서로 떨어지게 되는데, 이 거리를 결합 길이라고 한다.
하지만 이러한 안정된 상태가 쉽게 유지되기란 힘들다. 적절한 양의 에너지를 받으면 진동하는 핵은 평형에서 벗어나 결합이 깨지게 된다. 뿐만 아니라 주변에 다른 핵이 있고, 조건이 적절하면 새로운 결합이 생성될 수도 있는데 이것이 바로 기존의 결합이 깨지고 새로운 결합이 형성되는 화학반응(chemical reactions)이다.
2. 생성물과 반응물
화학 반응이 어떻게 새로운 물질을 만들어 내는지 알기 위해서는 반응물과 생성물의 성질을 비교해보면 된다. 예를 들어 가솔린과 산소의 반응에서 반응물은 가솔린과 산소의 혼합물이지만, 생성물은 물과 이산화탄소이다. 또, 나트륨과 염소의 반응에서 반응물은 반응성이 높은 나트륨 금속과 독성이 강한 염소 기체이지만, 생성물은 먹을 수 있는 소금(염화나트륨)이다. 이처럼 생성물이 반응물이 될 때에 많은 변화가 일어나지만, 절대 변하지 않는 원리 하나가 있다면 바로 질량의 보존이다.
3. 질량 보존에 대하여
질량 보존은 화학 반응 과정에서 물질이 새로 만들어지거나 사라지는 것이 아니라, 재배열된다는 사실을 가르쳐 준다. 이를 보여주는 화학 반응식은 이런 원리에 기초하고 있다. 화학 반응식은 양쪽의 질량이 같은 균형 반응식이어야 한다. 예를 들어 고체 황 원자 하나가 산소 분자 하나와 반응하여 이산화황을 만들 때,

이 식은 황 원자가 반응물 쪽에도 하나, 생성물 쪽에도 하나가 있는 균형 반응식임을 알 수 있다. 산소의 경우 반응물 쪽에는 분자의 형태로 산소 원자가 두 개 있었는데, 생성물 쪽에도 이산화 황의 형태로 두 개의 산소 원자가 있는 것을 알 수 있다. 수소와 산소가 반응하여 물을 생성할 때처럼, 반응물의 비가 1:1이 아닐 때에는 화학식 앞에 계수를 표기한다.

균형 반응식에서, 두 개의 수소 분자가 하나의 산소 분자와 결합하므로, 식 왼쪽에는 총 네 개의 수소 원자와 두 개의 산소 원자가 있는 것을 볼 수 있다. 이들은 물 분자 두개를 생성하는데, 각 물 분자는 수소 원자 두 개와 산소 원자 한 개로 이루어지므로, 식 오른쪽에도 총 네 개의 수소 원자와 두 개의 산소 원자가 있다. 따라서 식 왼쪽과 오른쪽의 수소와 산소의 질량이 같고, 전체 질량은 보존된다. 위에서 본 두 가지 예는 하나의의 생성물을 생성하기 때문에 화합 반응에 속한다.
4. 화합 반응이란?
두 개 이상의 반응물이 하나의 생성물을 만드는 화학반응은 화합반응(synthesis reactions)으로 분류된다. 앞에서 본 이산화 황과 물의 합성이 이에 속한다.
1)유기 합성
황은 인체 내에서중요한 역할을 하기 때문에, 유기합성(orgaic synthesis)라는 화합 반응의 또 다른 범주에서 매우 중요하게 여겨진다. 황을 포함하는 향균성 설파제를 합성하는 것과 같은 유기 합성의 예는 역사를 바꿀 정도로 영향력이 컸다.
2) 침전 반응
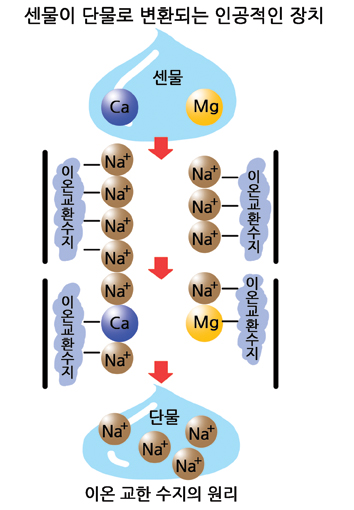
용액 속에서 고체 생성물이나 침전을 만드는 화학 반응을 침전 반응(precipation reactions)이라고 한다. 이런 화합의 예는 물속에 녹아있는 칼슘 이온와 탄소 이온 사이의 반응이다. 연의 거의 모든 물은 센 물에 속하는데, 센물이란 많은 양의 칼슘 이온과 마그네슘 이온들이 녹아있는 물을 뜻한다. 칼슘 이온은 대기 중의 이산화탄소가 녹아 만들어진 탄산 이온과 반응하여 스케일을 형성한다. 스케일이란 불용성 탄산 칼슘으로 수도관이나 주방기구, 접시 등에 남는 하얀 침전물이다. 이러한 침전물들은 물에 잘 녹지 않아 나중에 물의 흐름을 막을 수도 있다. 이를 방지하기 위해 경수 연화기를 사용할 수 있는데, 경수 연화기는 물 속의 칼슘 이온과 결합고 대신 연화기에 결합되어 있던 나트륨 이온이 물 속에 녹아들어 가게 한다.
'About Chemistry' 카테고리의 다른 글
| [4강 화학 변화] 산과 염기 (0) | 2020.04.13 |
|---|---|
| [4강 화학 변화] 연소와 분해, 산화와 환원 (0) | 2020.04.12 |
| [3강 다양한 상태의 물질] 전자가 모든 것을 결정한다. (0) | 2020.04.12 |
| [3강 다양한 상태의 물질] 물과 용액 (0) | 2020.04.11 |
| [3강 다양한 상태의 물질] 플라즈마에 대하여 (0) | 2020.04.11 |



