1. 오비탈과 물 분자에 관하여
오비탈을 정해진 공간이자 영역이라고 가정하는 것이 편하긴 하지만 사실 모양이 변하는 구름에 가깝다. 구름의 모양이 시시각각 변하듯이, 오비탈 내에 있는 전자들도 내부적, 외부적 전기장에 반응하여 변할 수 있다.

앞 포스팅에서도 이야기했듯이, 물 분자의 모양은 V자 형태이기 때문에 전자 분포가 균일한 구형을 이루지 못한다. 이 때문에 물은 내부 자기장을 형성하게 되고, 산소의 전기 음성도가 수소보다 크기 때문에 분자 내의 전자들을 산소가 수소보다 더 강하게 끌어당긴다. 전자 공유에서 나타나는 이러한 불균형 때문에 물 분자는 한쪽이 다른 쪽에 비해 음전하가 강한 쌍극자가 된다. 마치 자석처럼 한 쌍극자의 양전하 쪽은 다른 쌍극자의 음전하 쪽으로 이끌리는데, 이런 쌍극자 사이의 인력은 물이 응결될 수 있는 힘으로 작용한다. 분자 사이의 인력이나 반발력을 분자간 힘이라고 부른다. 이런 분자간 인력이 없다면, 모든 분자들은 영원히 기체상태로 존재할 수밖에 없을 것이다.
2. 응결은 물만 가능한가?
물은 쌍극자(양, 음의 극이 상대하고 있는 물질) 때문에 비교적 쉽게 응결하지만 쌍극자가 없는 분자들도 응결이 가능하다. 예를 들어 액체 질소는 동일한 두 개의 핵 사이에 전자가 불균등하게 분포될 수 없기 때문에, 영구 쌍극자를 가질 수 없다. 하지만 순간적으로 전자밀도가 한 쪽으로 쏠리면 이웃한 분자에도 전자의 쏠림을 일으킬 수 있다. 이를 분산력이라고 하는데, 일시적인 쌍극자-쌍극자 간의 인력이 존재하기 때문에, 온도한 충분히 낮춘다면 헬륨도 액화시킬 수 있는 것이다.

3. 수소 결합에 관하여
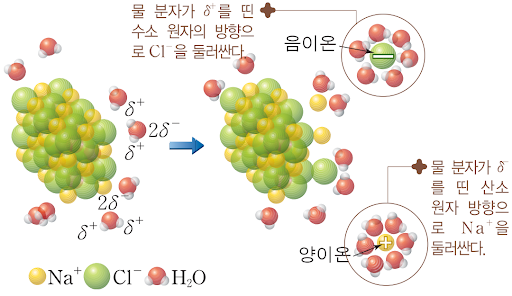
물은 질소와 달리 분자 내에 존재하는 영구 쌍극자 때문에 온도를 극단적으로 낮추지 않아도 액화될 수 있다. 하지만 물에는 아주 특별하고 강한 분자간 인력이 존재하는데, 이것이 바로 유명한 수소 결합(hydrogen bonding)이다. 수소 결합이란 물 분자의 수소 원자와 다른 물 분자 사이의의 산소 원자 사이의 인력이다. 물론 다른 분자들도 수소 결합이 가능하지만, 물은 독특한 V자 형태에서 몇 가지 특별한 성질이 나타난다. 그 중에 가장 중요한 것 하나는 대부분의 다른 액체들은 얼 때 부피가 줄어드는 반면, 물은 얼 때 부피가 늘어난다는 것이다. 그 이유는 물이 얼 때 물 분자 속의 수소와 산소가 수소 결합을 최대로 할 수 있도록 정렬되기 때문이다. 이러한 팽창은 자연상태에서 매우 중요한데, 얼음이 물 위에 뜰 수 있는 것, 그리고 바위에 틈을 만들어 부서질 수 있는 단초가 되어주는 것이다. 물이 수많은 화합물들을 녹일 수 있는 것도 이 수소결합 때문이다. 예를 들어 염화나트륨(소금)은 나트륨 양이온과 염소 음이온으로 구성되어 있는데, 물의 쌍극자 중 양하 쪽이 음이온에, 음전하 쪽이 양이온에 이끌리게 된다. 그 결과 물 분자는 이온 사이에 들어가 둘을 갈라놓게 되고, 물 분자 사이의 수소결합이 이온 주위를 둘러싸 이온들이 다시 결합하는 것을 막아주는 것이다.
4. 화학반응으로
쌍극자, 분산력 수소 결합은 전자구름을 모이게 한다. 그리고 전자들이 충분한 에너지를 가질 만큼 가까워지면, 전자구름이 병합되고 새로운 형태로 변신하여 새로운 분자를 만들어 낸다. 이것이 바로 화학 반응의 핵심으로, 이 주제는 다음 강의 포스팅에서 다뤄보도록 하겠다.
'About Chemistry' 카테고리의 다른 글
| [4강 화학 변화] 연소와 분해, 산화와 환원 (0) | 2020.04.12 |
|---|---|
| [4강 화학 변화] 화학 반응과 화합 반응 (0) | 2020.04.12 |
| [3강 다양한 상태의 물질] 물과 용액 (0) | 2020.04.11 |
| [3강 다양한 상태의 물질] 플라즈마에 대하여 (0) | 2020.04.11 |
| [3강 다양한 상태의 물질] 고체와 액체, 기체 (0) | 2020.04.02 |



